让 mRNA 在体内“看得见”,我国科学家在疫苗递送研究方面取得重要进展
1 月 4 日消息,中国科学院精密测量院超灵敏磁共振研究团队在 mRNA 疫苗递送研究方面取得重要进展。
研究人员成功设计出一种“自带定位信号”的脂质纳米粒,不仅能够高效递送 mRNA,还能在体内被“实时看见”,为系统揭示 mRNA 递送、蛋白表达与免疫激活之间的动态关系提供了全新研究手段。
相关研究成果于 1 月 2 日发表在《美国科学院院刊》上。精密测量院博士生解铠铷和博士后朱立军为文章共同第一作者,研究员周欣、陈代钦为共同通讯作者。
mRNA 疫苗本身非常“脆弱”,进入人体后极易被降解,因此必须借助脂质纳米颗粒(LNP)作为“运输工具”。但传统 LNP 存在一些长期困扰研究和应用的问题:
一方面,它们在体内的真实去向并不清楚;
另一方面,大量载体会被肝脏“误捕获”,既降低了靶组织递送效率,也增加了潜在安全风险。
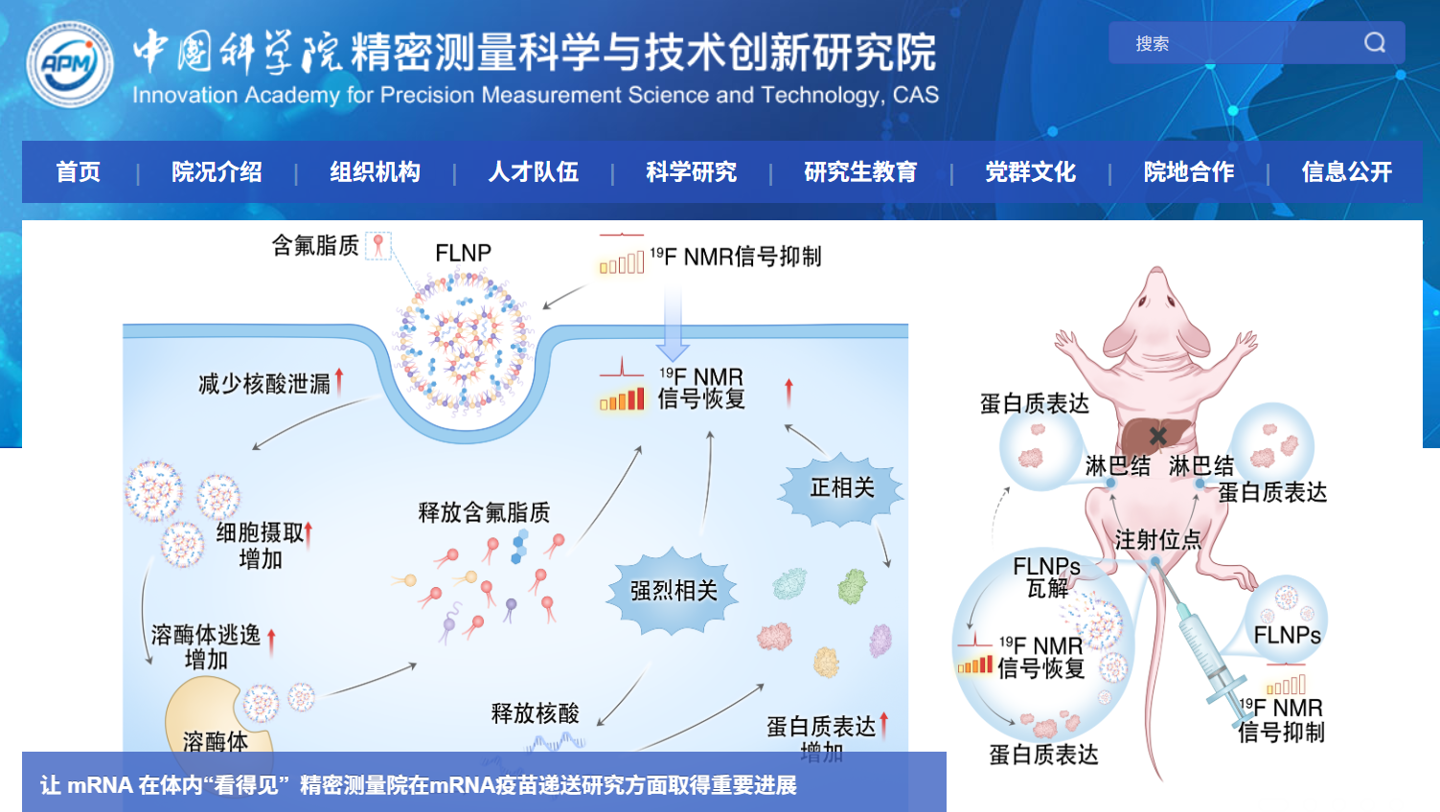
针对这一难题,研究员周欣带领的超灵敏磁共振研究团队在脂质纳米颗粒中引入了含氟结构单元,构建了一种全新的含氟脂质纳米颗粒(FLNP)。
这种设计相当于在纳米载体中安装了一个“专属信号灯”,可以被 19F 磁共振成像精准识别,而人体内几乎不存在天然背景信号,因此追踪过程清晰可靠。
实验结果显示,这种 FLNP 在保证 mRNA 蛋白表达效率与临床常用 LNP 相当的同时,肝脏非特异性富集显著降低,减少幅度达 94.6%。更重要的是,研究人员能够在活体条件下,连续观察纳米载体的体内分布、mRNA 释放过程以及抗原表达的时空变化,这是以往方法难以实现的。
在此基础上,团队进一步将“看见的纳米载体”与免疫学分析相结合,首次在体内建立了这样一条清晰链条:纳米载体到达哪里 → 抗原在哪里表达 → 免疫细胞如何迁移与激活。研究发现,注射部位首先发生局部免疫激活,随后抗原呈递细胞迁移至引流淋巴结,完成免疫应答的关键启动步骤。
这一研究从动态和机制层面回答了 mRNA 疫苗“如何在体内发挥作用”的核心问题,为理解免疫激活过程提供了直接证据。所建立的 FLNP 平台兼具精准递送与无创可视化追踪双重优势,为新一代 mRNA 疫苗和核酸药物的设计、安全性评估及疗效监测提供了重要技术基础。
附论文链接:
相关阅读
..:: 版权声明 ::..
- 网站旨在为用户提供资源整合服务,所有数据均由用户上传或发布,并力求提供准确有价值的相关资源。.网站只做相关资源展示没有做具体测试,希望网友自己区分下 。
- 若涉及到侵权违法的链接,请联系我们将第一时间处理。
- 我们会定期进行数据更新和优化以确保信息的时效性和可靠性。致力成为一个资源整合平台,提供各种网站资源的下载和能满足用户的游戏资讯。
- 感谢您对我们网站的支持,我们将持续努力提供更好的资源整合服务,希望能满足您的需求。

















